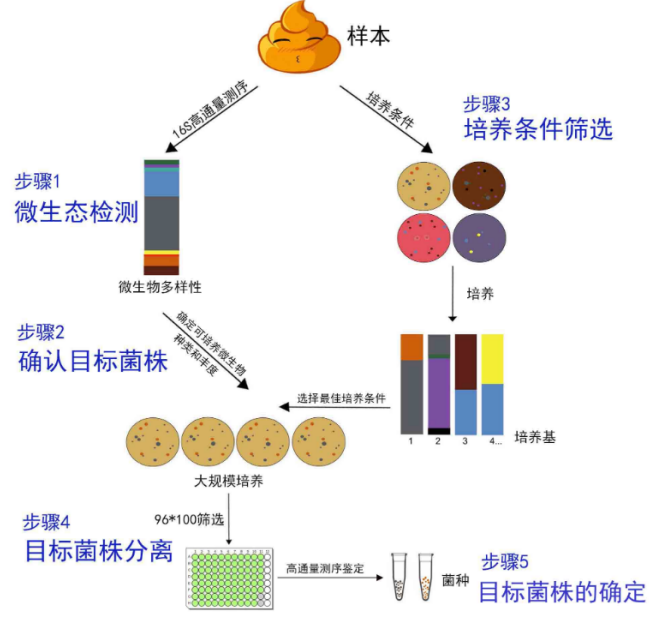
实验流程和目的
步骤一、原始样本微生态检测:
在进行分离培养前,需要确认待分离的样本中是否有目标菌株,这时我们需要通过高通量测序的方法来检测样本中微生物的种类和相对丰度。
如果老师希望分离细菌,那么可以选择16S V3-V4,或是16S V4-V5区域对原始样本进行测序。如果老师希望分析真菌,那么可以选择ITS序列进行测序。
步骤二、确认目标菌株
高通量检测原始样本中微生物的种类和相对丰度,确定后续要进行分离纯化的目标菌株。若样本中可以检测到目标菌株,则该样本可以进行后续的实验。若原始样本中没有目标菌株,则建议更换样本。
如果测序结果中没有老师需要的菌株,但是老师有指定菌株的16S序列,我们也可以分析测序结果中有没有和老师目标16S序列一致的OTU(或是ASV)的代表序列,这样分析,主要是高通量测序结果中有些微生物没有鉴定到具体的种,这时我们可以根据16S的序列来判断目标菌株在原始样本中的相对丰度。
步骤三、培养条件筛选:
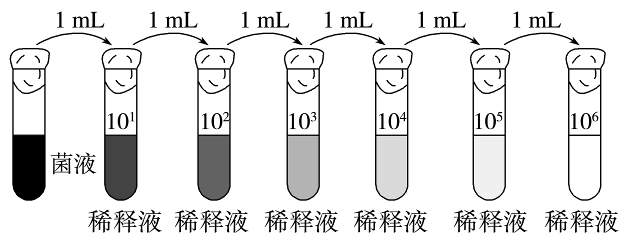
根据目标菌株查找相关的培养基信息(这个步骤尽量多采用几种培养基),将不同的培养基分别配置成固体平板,将样本进行梯度稀释(如下图1所示)。
图1 梯度稀释的方法
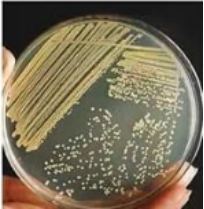
取部分菌液涂布到不同的培养基,按照指定的培养条件进行培养,稀释倍数低的样本会在平板上长成菌苔,而稀释倍数高的样本则会形成单菌落。例如下图2所示,从左至右样本的稀释倍数分别为10倍(菌苔)、100倍(菌落)和1000倍(菌落)。
图2 梯度稀释涂布平板培养后的菌苔和菌落
每种培养基挑选一个菌苔的平板和一个菌落的平板(如上图的第1板和第2板),收集的菌体取部分进行16S/ITS高通量测序,剩余菌体加保护剂冻存。生信分析培养出来的微生物种类和相对丰度,看在哪种培养基上能够明显富集目标微生物。
若在一种培养基的菌苔和菌落中目标菌株的相对丰度都很低,则表明该菌株不适合用此种方法培养,需要更换其他的培养条件。若目标菌株在菌落平板上有培养出来,且相对丰度较高,则表明该菌株比较容易在此培养基上培养出来,可以用这种培养方法做后续的分离和纯化。若目标菌株在菌苔样品中的相对丰度较高,而在菌落样品中的相对丰度较低,则表明此菌株可能和其他菌株之间存在共生关系,此时需要考虑使用共培养的方法或使用共生菌的替代物对目标菌株进行分离纯化。
步骤四、目标菌株分离:
根据菌苔和菌落的16S高通量结果,选择最适合目标菌株的培养方法,按照步骤三的方法,将原始样本稀释后进行涂板培养,挑选平板上的单克隆于96孔板中进行摇菌培养。取扩培后部分进行进行菌种保存,剩余的菌进行16S/ITS高通量测序,根据测序结果初步筛选出目标菌株。
步骤五、目标菌株纯化:
初筛得到的菌株中可能还存在杂菌,因此需要对菌株进一步纯化。取少量菌体在培养基平板上作四区划线纯化(如图3所示),根据目标菌株的纯度,纯化2-3代,并进行一代或是二代测序验证,最终获得纯菌株。
图3 四区划线
备注:
有限梯度稀释培养:对于不适合在固体培养基平板上生长的菌株,可以采用有限梯度稀释法进行分离纯化。
名词注释:
1、厌氧培养、需氧培养:
厌氧培养(anaerobic culture)指把微生物置于与分子态氧隔绝状态下(一般是在厌氧手套箱中)进行的培养,适用于兼性厌氧菌和专性厌氧菌。
需氧培养(aerobic culture)与厌氧培养相对的,微生物直接再空气条件下践行培养。
2、厌氧手套箱:
厌氧手套箱(Anaerobie glove box)是迄今为止国际上公认的培养厌氧菌最佳仪器之一。它是一个密闭的大型金属箱,箱的前面有一个有机玻璃做的透明面板,板上装有两个手套,可通过手套在箱内进行操作。
3、梯度稀释和取样涂板:
梯度稀释就是依次稀释样本,比如取1mL原液加入9mL稀释液中稀释10倍,混匀后,再从这里面取1mL与9mL稀释液混和,依次类推,称梯度稀释。
4、菌落(colony)/单克隆(clone):
指由单个细胞在适宜的固体培养基表面或内部生长繁殖到一定程度,形成以母细胞为中心的一团肉眼可见的、有一定形态和构造等特征的子细胞集团。每一种细菌在一定条件下形成的菌落特征是固定的,而不同种或同种在不同的培养条件下形成的菌落特征是不同的。这些特征对菌种识别和鉴定有一定意义。
5、菌苔(lawn):
与菌落的概念不同,如果是许多细菌菌体接种在固体培养基上,经培养后长成密集的、不规则的片状的细胞群体,则称为菌苔。
6、平板划线纯化:
平板划线法是指把混杂在一起的微生物或同一种微生物群体中的不同细胞用接种环在培养基平板表明通过分区划线稀释而得到较多独立分布的单个细胞,经培养后生长繁殖成单菌落,通常把这种单菌落当作待分离微生物的纯菌种。有时这种单菌落并非都由单个细胞繁殖而来,因此必须反复分离多次才可得到纯菌株。
7、稀释涂布平板法和平板划线法的区别
稀释涂布平板法一般多用于筛选菌株,而平板划线法一般多用于纯化菌株。二者目的不完全相同。
8、细菌16S rRNA:
细菌核糖体RNA(rRNA)有三种类型:5S rRNA(120bp)、16S rRNA(约1540bp)和23S rRNA(约2900bp)。5S rRNA基因序列较短,包含的遗传信息较少,不适于细菌种类的分析鉴定;23S rRNA基因的序列太长,且其碱基的突变率较高,不适于鉴定亲缘关系较远的细菌种类;16S rRNA普遍存在于原核细胞中,且含量较高、拷贝数较多(占细菌RNA总量的80%以上),便于获取模板,功能同源性高,遗传信息量适中,适于作为细菌多样性分析的标准。16S rRNA编码基因序列共有9个保守区和9个高可变区。其中,文献中常用的区域是V1-V2,V3-V4,V4-V5等区域。
9、真菌ITS:
ITS序列是内源转录间隔区(Internally Transcribed Spacer),位于真菌18S、5.8S和28S rRNA基因之间,分别为ITS 1和ITS 2。在真菌中,5.8S、18S和28S rRNA基因具有较高的保守性,而ITS由于承受较小的自然选择压力,在进化过程中能够容忍更多的变异,在绝大多数真核生物中表现出极为广泛的序列多态性。同时,ITS的保守型表现为种内相对一致,种间差异较明显,能够反映出种属间,甚至菌株间的差异。ITS序列片段较小(ITS 1和ITS 2长度分别为350bp和400bp),易于分析,目前已被广泛用于真菌不同种属的系统发育分析。
10、一代测序:
即Sanger测序,主要特点是测序读长可达1000bp,准确性高,但是其通量低,只能对纯菌样品进行测序,无法对混合样品进行测序。
11、高通量测序:
又称二代测序技术,将DNA片段加上接头后,制备测序文库,通过对文库中数以万计的DNA片段进行延伸反应,检测对应的信号,最终获取序列信息。与Sanger法为代表的传统一代测序法相比,高通量测序技术在处理大规模样品时具有显著的优势,又快又多,成为目前组学研究的主要技术。
12、物种丰度:
指群落内物种数目的多少。物种丰度可分为绝对丰度和相对丰度。绝对丰度可以用于描述单个物种的绝对含量,表征其在不同或相同的环境群落里数量的增减;相对丰度主要用于描述单个物种占整个环境群落的百分比,用于描述单个物种的优势程度。相对丰度可以通过单个物种的绝对丰度除以整个群体总量来换算成单个物种的相对丰度。
上述流程中指的高通量测序得到的相对丰度的计算公式为:
目标菌株的相对丰度=目标菌株的sequence数/该样本中总的sequence数*100%。
13、菌落PCR:
聚合酶链式反应(PCR)是一种用于放大扩增特定的DNA片段的分子生物学技术,它可看作是生物体外的DNA复制,其最大特点是能将微量的DNA大幅增加。菌落PCR是以少量经过裂解处理的菌体作为模板进行的PCR反应。
14、共培养:
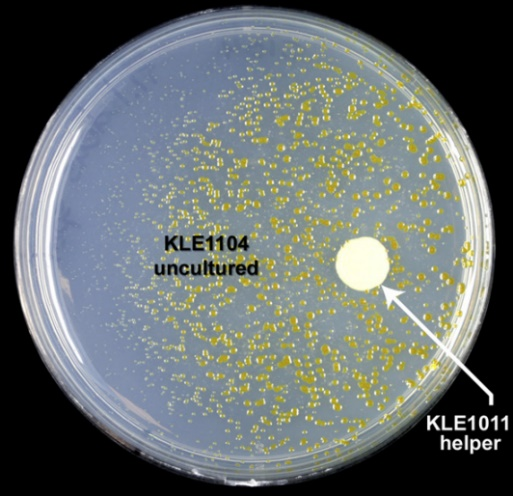
有些菌株需要依赖其他菌株分泌的代谢物才能生长,在没有其他菌株辅助的情况下则很难甚至不会生长,这类菌株被称为共生菌。若想要分离并纯化此类菌株,需要在培养基中加入与其共生的菌株作为辅助培养物。如下图4所示,黑色字体标出的黄色菌落为目标菌,白色箭头指出的即为与目标菌株共生的辅助菌株。
图4 共培养实验
15、拿到纯菌后可以做什么?
当拿到分离纯化好的菌株后,可以对菌株进行基因组草图、完成图的实验,还可以进行菌株代谢物的检测,包括胞内、胞外代谢物,还可以进行动物实验,总之可以根据实验的需求进行不同的实验。
16、菌株扩培:
分离纯化出来的菌株一般只有少量的菌种,如果进行后继实验,那么需要对菌株进行放大培养,以获得足够数量和质量的菌株进行后继实验,实验室规模的一般是摇瓶培养,如果需要更大规模的培养,一般采用发酵罐。

 微基生物 您自己的微生态研究团队|专注微生态研究与应用
微基生物 您自己的微生态研究团队|专注微生态研究与应用