实时聚合酶链式反应(PCR)是基于PCR的革命性方法。依赖于目标序列的高度特异性和高效扩增,以及荧光报告分子的加入,从而能够实时定量PCR产物。
特定微生物菌株及菌群的qPCR定量检测,对目标序列高效且特异性的扩增要求更高。探针法qPCR要达到检测的目的,不仅要上下游引物要跟模板匹配,还需要探针与模板匹配,提升了检测的特异性。对于模板同源性比较高的不同目的基因的检测和鉴定,在扩增引物特异性没法保证的情况下,可通过设计探针的特异性来达到特异性检测的目的。微基生物推荐使用具有目标特异性的荧光探针TaqMan方法。
以下是qPCR定量分析检测中常用的两个方法,嵌合荧光染料法SYBR Green和荧光探针法TaqMan简单解读:
嵌合荧光染料和基于水解的荧光探针检测的原理比较
文献:A beginner’s guide to RT-PCR, qPCR and RT-qPCR
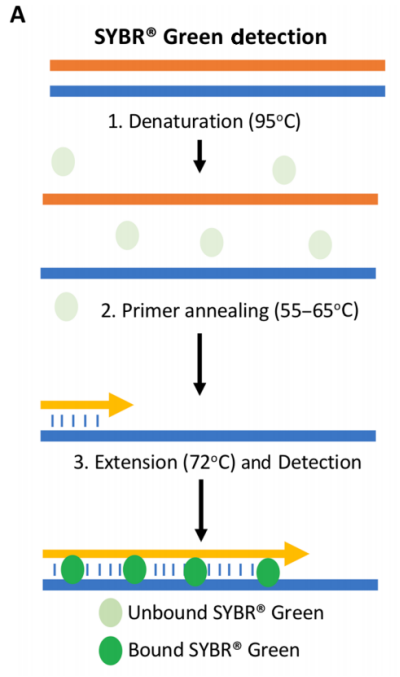
A.SYBR®Green 检测:cDNA变性后,引物退火并延伸。在延伸过程中,SYBR Green与双链DNA(dsDNA) 结合,发出荧光信号,可被qPCR仪器检测到。
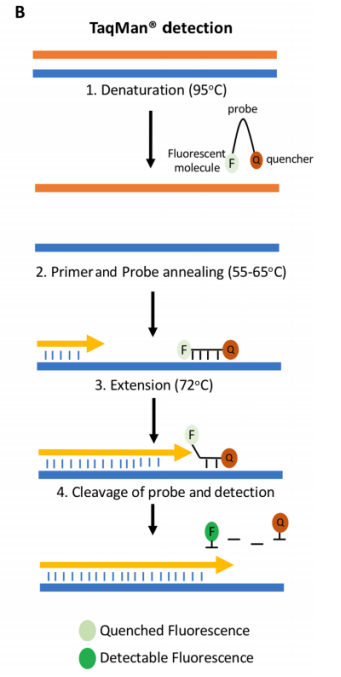
B.TaqMan®探针检测:TaqMan 探针将引物下游与单链cDNA结合。在延伸过程中,聚合酶会分解探针,由于失去与淬灭剂部分的接近度,从而可以检测到荧光信号。
引物可以在扩增反应中与DNA结合染料结合使用,以监测双链DNA(dsDNA)的出现。荧光标记的探针可用于在qPCR测定中获得更高的特异性。
示例解读:鹅源星状病毒TaqMan探针和SYBR Green I染料法荧光定量PCR检测方法的建立及其应用比较(2022)
探针法和染料法荧光定量PCR的比较
以倍比稀释的标准品质粒作为模板,对本试验建立并优化的2种荧光定量PCR检测方法进行特异性、敏感性和重复性的验证及比较。
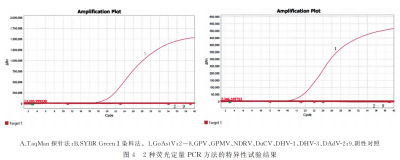
特异性试验
结果显示:2种荧光定量PCR方法均仅对GoAstV有特异性扩增,其他病原及阴性对照均无特异性扩增,特异性良好。
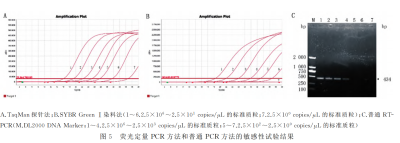
敏感性试验
结果显示:本试验建立的TaqMan和SYBR Green I荧光定量PCR方法分别比普通RT-PCR方法的灵敏度高100倍和10倍;TaqMan法比SYBR Green I染料法灵敏度高10倍,说明TaqMan探针法荧光定量PCR方法的灵敏性更高。
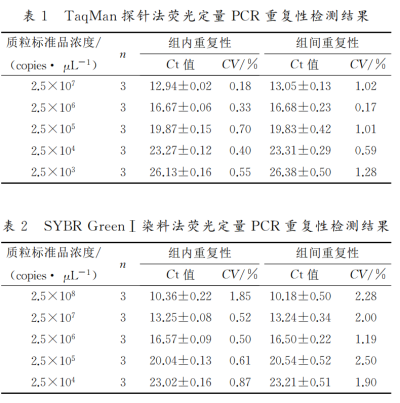
重复性实验
结果显示:TaqMan荧光定量PCR方法的组内变异系数和组间变异系数均小于 SYBR Green I荧光定量PCR的组内变异系数和组间变异系数,说明TaqMan荧光定量PCR方法重复性更好,更加稳定。
临床样品检测
临床上71份样品进行检测,TaqMan荧光定量PCR方法检测出阳性35例,检出率为49.3%;SYBR Green I荧光定量PCR方法检测出阳性30例,检出率为42.25%;普通RT-PCR方法检测出阳性21例,检出率为29.58%。结果显示TaqMan荧光定量PCR方法的检出率最高,与敏感性试验结果相一致。
对于特定微生物菌株及菌群的qPCR定量检测微基生物推荐使用探针法,如您有实验需求,欢迎联系我们: 400-660-9270,我们将竭诚帮助您达成实验目标。

 微基生物 您自己的微生态研究团队|专注微生态研究与应用
微基生物 您自己的微生态研究团队|专注微生态研究与应用